Pesquisa com proteína p53 aponta novos caminhos para diagnóstico e tratamento do câncer
Por Ascom Faperj
 |
|
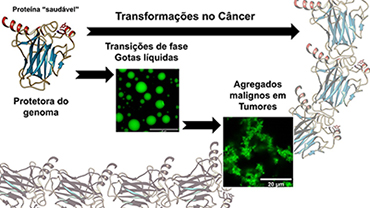
Os agregados malignos da p53 acontecem devido à transição |
Mesmo sendo resultado de "pesquisa básica", devido à sua importância, a notícia foi publicada nos principais veículos de comunicação do País e ganhou a capa da edição do final de abril da Chemical Science, publicação da Royal Society of Chemistry, especializada em assuntos relacionados à química aplicada à biologia e medicina: pesquisadores da Universidade Federal do Rio de Janeiro (UFRJ), sob a coordenação do professor do Instituto de Bioquímica Médica Leopoldo de Meis (IBqm/UFRJ) e presidente da FAPERJ, Jerson Lima Silva, anunciaram uma importante descoberta sobre alterações em uma proteína, a p53, que pode sofrer alterações que estariam na origem de percentual expressivo dos casos de câncer. Envolvida em centenas de processos essenciais do corpo humano, a p53 tem como função principal preservar a integridade do código genético em cada célula, ou seja, a manutenção da mesma sequência ao longo de toda a molécula de DNA. Quando há divisão celular, a p53 verifica eventual ocorrência de mutação na sequência do código genético, evento decorrente de uma duplicação defeituosa do DNA. Caso haja uma alteração, é função da p53 impedir que a divisão celular se complete. Os agregados malignos da p53 acontecem devido à transição de fase da proteína p53 mutada, que passa do seu estado líquido para gel, e, em seguida, para o sólido, tornando-se irreversíveis, iniciando a multiplicação e o surgimento de tumores. É quando a proteína deixa de ser guardiã e passa a ser vilã.
Por isso, desta vez, os pesquisadores focaram seus estudos no nível molecular da proteína e, com a ajuda de tecnologia de ponta como a microscopia eletrônica de transmissão, espectroscopia de ressonância magnética nuclear e de microscopia de fluorescência, conseguiram analisar cada etapa da sequência de eventos que dão origem aos anômalos.
A pesquisa, que recebeu apoio financeiro da FAPERJ e do CNPq e abre possibilidades futuras para um possível tratamento do câncer, também irá ajudar a esclarecer o processo de formação dos tumores e auxiliar o desenvolvimento de novas ferramentas para exame e diagnóstico precoce e prognóstico do câncer. Os dois primeiros autores do trabalho, Elaine Petronilho e Murilo Pedrote, são bolsistas de pós-doutorado da FAPERJ. De acordo com os pesquisadores, a análise dos aglomerados já revelou que algumas substâncias impedem a agregação da p53, outras desfazem os agregados, e essas observações podem contribuir para o desenvolvimento de medicamentos que evitem os aglomerados. O desafio será conseguir evitar os agregados sem prejudicar as funções da p53. Devido a suas múltiplas e fundamentais funções, a p53 alterada também está envolvida em outras doenças, como mal de Parkinson, Alzheimer e esclerose lateral amiotrófica (ELA). O Boletim Faperj entrevistou o professor Jerson Lima, coordenador do estudo:
 |
|
Jerson Lima: professor titular da UFRJ e presidente da FAPERJ, |
Boletim Faperj: Muitos grupos de pesquisa no Brasil e no mundo estudam a P53. Qual foi o caminho seguido pela equipe do IBqM para chegar a essa descoberta?
Jerson Lima: No início da década de 2000, o nosso grupo estudava várias proteínas que formam agregados amiloides tóxicos na célula e estão envolvidas em doenças neurodegenerativas como Parkinson, Alzheimer e doenças priônicas. No caso da p53, sabíamos que as mutações somáticas (em um único gene) estavam associadas à maioria dos tipos de câncer. Começamos a estudar a p53 e, em 2003, publicamos dois trabalhos pioneiros que apontaram para o caráter amilóide do tipo príon da agregação de p53 e sua relevância para o câncer. Logo em seguida verificamos que esses agregados amilóides de p53 mutante eram encontrados em células de câncer de mama, o que mostra sua relevância biológica. Esses resultados foram confirmados posteriormente por outros grupos em diferentes tipos de câncer, como tumores de pele, prostáticos e ovarianos. Essa descoberta pioneira mostrava que que a proteína p53 mutante exerce um efeito regulador dominante negativo na proteína p53 do tipo selvagem, uma vez que pode arrebanhar essa proteína funcional para estes agregados, bem com conferir efeitos de ganho de função oncogênica (resistência à quimioterapia, por exemplo) ao coagregar a outras proteínas como p63, p73 e outros fatores de transcrição, privando a célula de várias proteínas importantes que deixam de exercer suas funções por estarem retidas nesses agregados. Em vários artigos mais recentes temos demonstrado o grande potencial de usar a inibição da agregação de p53 como um alvo importante contra o câncer. Nesse cenário, o grupo tem usado como estratégica a identificação de novos compostos capazes de prevenir a formação de agregados da p53, tais como moléculas naturais e sintéticas, como análogos do resveratrol, pequenos peptídeos sintéticos, aptâmeros de ácidos nucléicos, glicosaminoglicanos, dentre outros. Nesse trabalho mais recente, o grupo fornece o caminho celular da formação desses agregados. Os agregados “malignos” de p53 seriam resultado de um fenômeno conhecido como transição de fase, quando uma molécula sai de um estado equivalente a gotas líquidas e se transforma em condensados de gel ou mesmo em agregados sólidos e irreversíveis. Essa foi a descoberta mais importante desse trabalho.
Há quanto tempo não havia um resultado tão significativo nas pesquisas acerca do câncer?
O câncer não é uma doença única, são muitas doenças que podem se beneficiar com essa descoberta. O fato de mais de 50% dos tumores malignos possuírem mutação de p53, torna a mudança de fase dentro da célula da p53 e consequente agregação um alvo perfeito para terapias. Se nenhuma nova terapia for desenvolvida, o câncer associado às mutações na proteína p53 levará à morte de mais de meio bilhão de pessoas nas próximas décadas. O nosso trabalho ganhou destaque porque detalha o caminho dentro do núcleo da célula onde o processo de mudança de fase pode ocorrer. Tanto a separação como a transição de fases desempenham papéis importantes no funcionamento de macromoléculas no interior das células, permitindo que diferentes componentes celulares se liguem e formem estruturas como o nucléolo, localizado no núcleo celular e composto de proteínas, DNA e RNA. O nosso estudo mostra como moléculas de RNA, muito presentes no núcleo e especialmente no nucléolo, podem afetar o curso das alterações da p53, transformando-a de um fator de supressão tumoral para um fator oncogênico (estimulador de tumores).
Essa descoberta pode fazer com que a indústria farmacêutica invista mais em pesquisas com a P53?
Exatamente, porque esse caminho está agora parcialmente desvendado e a indústria farmacêutica, junto com os grupos de pesquisa, pode desenvolver medicamentos que atuem na agregação da p53 mutada. Há dois anos, demonstramos que um medicamento antitumoral (Prima-1), que está em fase 3 de pesquisa clínica, tem como principal mecanismo de ação a inibição da agregação de mutantes de p53.
Num cenário futuro, essa pesquisa contribuiria para melhor o tratamento com Imunoterapia?
Toda doença mais complexa precisa ser tratada com mais de um medicamento. Além das imunoterapias já disponíveis para tratamento de algumas formas de câncer, pode-se inclusive desenvolver anticorpos monoclonais que impeçam a agregação da p53 e restabeleçam a função de supressão tumoral.

 FAPERJ - Fundação Carlos Chagas Filho de Amparo à Pesquisa do Estado do Rio de Janeiro
FAPERJ - Fundação Carlos Chagas Filho de Amparo à Pesquisa do Estado do Rio de JaneiroAv. Erasmo Braga 118 - 6º andar - Centro - Rio de Janeiro - RJ - Cep: 20.020-000 - Tel: (21) 2333-2000 - Fax: (21) 2332-6611
Página Inicial | Mapa do site | Central de Atendimento | Créditos | Dúvidas frequentes



